유씨비, 전신 중증근무력증 치료제 '리스티고주' 마카오 카지노 슬롯 머신
다케다, 올해 중 자소시티닙 건선 3상 결과 발표 …'26년 내 마카오 카지노 슬롯 머신 신청
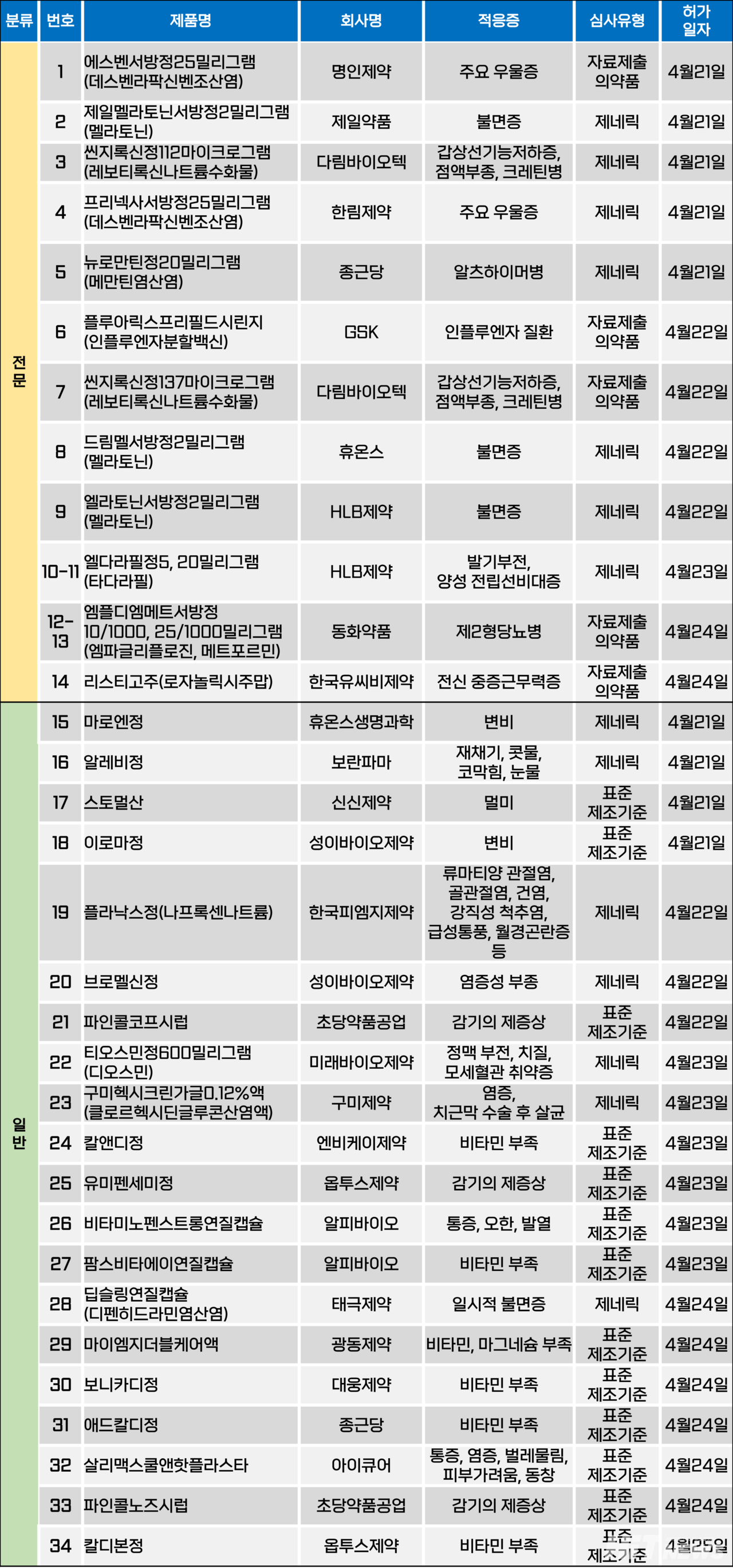
지난주(4월 21~25일) 총 34개 품목이 식품의약품안전처에서 품목마카오 카지노 슬롯 머신를 받았다. 전문의약품 14개, 일반의약품 20개 품목이다. 이들은 주요 우울증, 불면증, 제2형당뇨병, 전신 중증근무력증, 갑상선기능저하증 등 적응증으로 마카오 카지노 슬롯 머신됐다.
유씨비가 개발한 전신 중증근무력증 치료제 '리스티고주(성분 로자놀릭시주맙)'가 지난 24일 마카오 카지노 슬롯 머신됐다.
중증근무력증은 신경 근육 접합부 성분을 표적으로 하는 자가항체 IgG(면역글로불린 G)로 인한 자가면역질환이다. 신경근으로의 신호 전달이 감소하고, 전신의 근력이 약화되는 것이 주 증상이다.
리스티고는 인간화 IgG4 단일 클론 항체로, 항체 재활용에 관여하는 신생아 Fc 수용체(FcRn)와 IgG의 결합을 억제해 병원성 IgG 자가항체의 농도를 감소시킨다. 이 기전으로 항아세틸콜린 수용체 항체 양성, 항근육 특이 티로신 키나제 항체 양성 전신 중증근무력증 환자를 치료한다.
한편, 이번 마카오 카지노 슬롯 머신 외에 한국유씨비제약이 올해 중 국내에 도입할 것으로 예상되는 희귀의약품으로는 '핀테플라(성분 펜플루라민)'이 있다.
핀테플라는 드라벳 증후군 및 레녹스-가스토 증후군과 관련된 발작치료제로 개발됐다.이들 중에서도 국내에서 드라벳 증후군 적응증이 먼저 마카오 카지노 슬롯 머신될 것으로 보이며,현재 식약처 마카오 카지노 슬롯 머신 심사를 진행 중인 것으로 나타났다.
핀테플라는 만 2~18세 소아청소년 드라벳 증후군 환자를 대상으로 한 3상 임상을 바탕으로 작년 3월 희귀의약품으로, 같은 해 6월 글로벌 혁신제품 신속심사(GIFT) 30호로 지정됐다. GIFT 마카오 카지노 슬롯 머신 심사 기간을 고려해봤을 때, 특이 보완 요소가 없을 경우 올해 중 마카오 카지노 슬롯 머신가 유력하다.
또, 미국 FDA가 핀테플라를 드라벳 증후군을 포함해 레녹스-가스토 증후군의 적응증까지 모두 마카오 카지노 슬롯 머신한 만큼, 회사는 향후 레녹스-가스토 증후군를 대상으로 별도의 희귀의약품으로 추가로 지정 받아 마카오 카지노 슬롯 머신 심사를 진행할 것으로 전망된다.
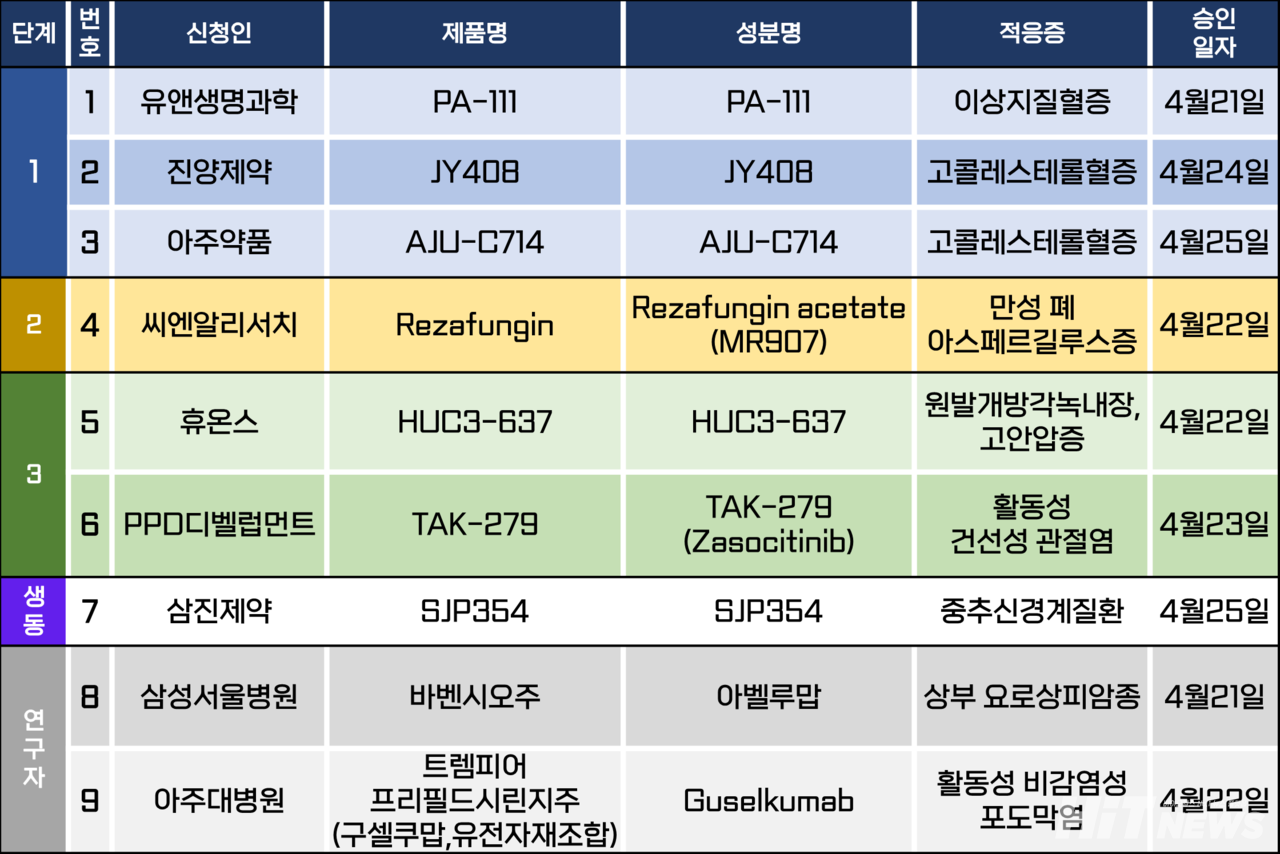
임상시험계획은 총 9건이 승인됐다. 세부적으로 △1상 3건 △2상 1건 △3상 2건 △생물학적 동등성 1건 △연구자임상 2건 등이다. 이 임상시험들은 이상지질혈증, 만성 폐 아스페르길루스증, 원발개방각녹내장, 고안압증, 활동성 건선성 관절염 등 질환을 대상으로 승인됐다.
다케다가 개발 중인 경구용 TYK2 억제제 '자소시티닙'의 활동성 건선성 관절염 대상 3상 임상시험계획이 지난 23일 승인됐다.
TYK2신호는 궤양성 대장염, 크론병, 건선 등 염증성 질환의 주요 원인으로 알려진 'IL-23/IL-17'경로의 중심 연결고리로 알려져 있다. 자소시티닙은 이 신호를 선택적으로 저해한다. 현재 국내 마카오 카지노 슬롯 머신된 TYK2 억제제는 브리스톨마이어스스큅(BMS)이 개발한 소틱투(성분 듀크라바시티닙)이 유일하다.
임상수탁기관(CRO) 피피디디벨럽먼트는 지난 23일 생물학적 질병 조절 항류마티스제 투여 경험이 없는 활동성 건선성 관절염 환자를 대상으로 자소시티닙(연구명 TAK-279)의 유효성 및 안전성을 평가하기 위한 다기관, 무작위배정, 이중눈가림, 위약 및 활성대조 3상 임상시험계획을 승인받았다(연구명 LATITUDE-PsA-3001).
이번 연구는 16명의 국내 환자(글로벌 1088명)를 대상으로 △아주대병원 △가톨릭대 성빈센트병원 △서울아산병원 △서울시 보라매병원 △경희대병원 등 의료기관에서 오는 2028년 1월까지 진행될 예정이다.
환자들은 1:1:1:1로 무작위배정돼 4가지 요법(자소시티닙 용량A 1일 1회, 자소시티닙 용량B 1일 1회, 활성 대조약, 위약) 중 1가지를 투여받는다.
이번 임상의 1차 유효성평가변수는 제16주에 '미국류마티스학회(American College of Rheumatology, ACR)20'을 달성하는 시험대상자의 비율이다. ACR20은 류마티스 증상이 20% 개선되는 것을 말한다.
더불어 최소 질병 활성도(MDA), 건선 면적 및 중증도 지수(PASI), ACR50 및 70,제16주 만성 질환 요법의 기능적 평가(FACIT)에서 피로 점수의 베이스라인 대비 변화 등이 주요 유효성평가변수로 설정됐다.
한편, 한국다케다제약 현재 국내에서 중증도 내지 중증 판상 건선, 활동성 궤양성 대장염과 크론병 등 주요 면역 질환의 2~3상 임상을 모두 진행 중에 있다.
다케다 본사는 작년 12월 보도자료를 통해 자소시티닙을 포함한 주력 개발 제품에 대한 예상 출시 시기와 매출을 공개한 바 있다. 대상 제품은 오베포렉스톤, 루스페르타이드, 메자기타맙, 파지르시란, 엘리터셉트 등이다.
크리스토프 베버 다케다 최고경영자(CEO)는 "우리는 2030년 이후까지 지속 가능한 매출 성장을 달성하기 위해 혁신 파이프라인 발전과 더불어 후기 단계 프로그램 가속화에 집중하고 있다"며 "이들 6개 제품의 예상 매출은 100~200억달러로 예상된다. 자소시티닙(건선), 오베포렉스톤(제1형 기면증), 루스페르타이드(진성적혈구증가증) 등 3개 제품은 2025년까지 3상 결과를 도출한 후 2026년 내로 품목마카오 카지노 슬롯 머신를 신청할 계획"이라고 밝혔다.
