옥타이로, ROS1 양성 폐암ㆍNTRK 양성 종류 무관 고형암 사용 가능
아토피치료제 '엡글리스', 손발톱 피부염 환자 대상 3상 승인

지난주(6월 2~6일) 총 12개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품 9개, 일반의약품 3개 품목이다. 이들은 위식도역류질환, 불면증, 고혈압, 안구 가려움증, 비소세포폐암 적응증으로 허가됐다.
차세대 티로신 인산화효소 억제제(TKI) '옥타이로(성분 레포트렉티닙)'가 희귀의약품으로 허가됐다.
한국BMS제약은 지난 5일 옥타이로를 ①ROS1 양성 국소 진행성 또는 전이성 비소세포성폐암 성인 ②NTRK(Neurotrophic tyrosine receptor kinase) 유전자 융합을 보유한 성인 및 12세 이상 소아의 국소 진행성, 전이성 또는 수술적 절제 시 중증으로 이환될 가능성이 높은 고형암 치료에 사용할 수 있도록 허가했다.
ROS1와 NTRK 유전자 돌연변이는 체내에서 비정상적인 단백질 발현을 지속적으로 유도해 세포의 증식 및 생존에 관여하는 하위 세포 신호 경로를 활성화한다. 이는 암세포의 증식으로 연결될 수 있다.
옥타이로는 바로 이 두 유전자 변이로 생성된 ROS1 및 TRK 단백질을 억제해 암세포의 성장과 생존을 저해하고, 암세포 사멸을 유도한다.
이번 옥타이로의 허가는 1/2상 슬롯사이트인 'TRIDENT-1'연구를 기반으로 이뤄졌다. 이 연구에 포함된 NTRK 양성인 15가지 유형의 고형 종양을 보유한 이전에 TKI 계열 치료제를 투여 받은 경험이 없는 40명, 투여 경험이 있는 48명의 환자가 포함됐다.
연구 결과(중앙 추적 관찰 기간 17.8개월), TKI 미경험 환자들의 58%(95% CI : 41-73)이 확인된 객관적반응률(cORR)을 보였다. 이 중 15%는 완전 관해(CR), 43%는 부분 관해(PR)를 나타냈다. TKI 미경험 환자의 83%에서 1년 후에도 반응이 지속되는 것을 보였으며, 이는 중앙값에 도달하지 않았다.
또, TKI 경험 환자들은 20.1개월 중앙추적 관찰 시점 cORR은 50%(95% CI: 35-65)을 기록했으나, CR을 달성한 환자는 없었다. 투여 1년 후 42%의 환자에서 반응이 지속되는 것이 확인됐으며, 중앙값(mDoR)은 9.9개월(95% CI : 7.4-13.0)였다.
전체 환자 중 이상반응으로 인해 슬롯사이트시험 참여를 중단한 환자는 7% 였으며, 35% 환자에서 심각한 이상반응이 발생했다. 가장 흔하게 보고된 이상반응은 △현기증(60%) △미각이상(54%) △말초신경병증(49%) △변비(38%) 등 순이었으며, 참여 환자 중 2% 이상에서 보고된 심각한 이상반응에는 △폐렴(6.3%) △호흡곤란(3.1%) △흉수(pleural effusion, 2.6%) △저산소증(2.6%)가 포함됐다.
BMS 본사 측은 작년 6월 "그동안 미국 식품의약품(FDA)으로부터 허가된 NTRK 양성 암에 대한 치료 옵션이 없었다. 하지만, 옥타이로의 허가로 다양한 유전자 마커를 통해 더 많은 환자에게 슬롯사이트적 가치를 제공할 수 있게 됐다"고 밝힌 바 있다.
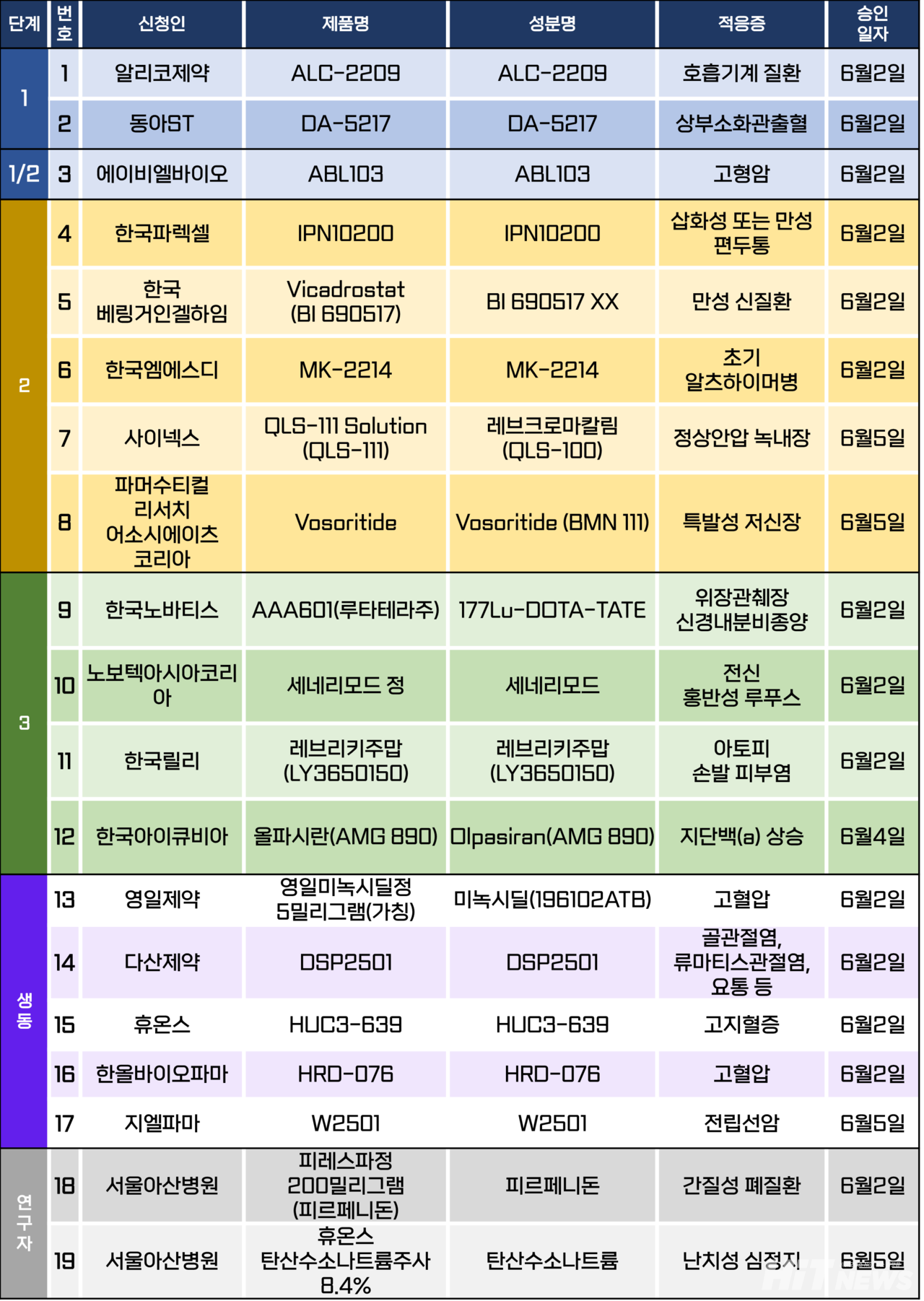
슬롯사이트시험계획은 총 19건이 승인됐다. 세부적으로 △1상 2건 △1/2상 1건 △2상 5건 △3상 4건 △생물학적 동등성 5건 △연구자 슬롯사이트 2건 등이다. 이 슬롯사이트시험들은 상부 소화관 출혈, 만성 편두통, 알츠하이머병, 정상안압 녹내장, 전신 홍반성 루푸스, 고혈압, 고지혈증 등 질환을 대상으로 승인됐다.
일라이 릴리가 개발한 아토피 피부염 치료제 '엡글리스(성분 레브리키주맙)'의 아토피 손발 피부염 환자 대상 3상 시험이 진행된다.
엡글리스는 아토피 피부염의 주요 발생원인이자 예방과 치료의 핵심으로 꼽히는 IL-13(인터루킨-13)을 선택적으로 차단하는 단일클론항체(IgG4)다.
한국릴리는 지난 2일 중등도 내지 중증 아토피 손발 피부염이 있는 성인 및 청소년 환자들에서 엡글리스의 유효성과 안전성을 평가하기 위한 무작위 배정, 이중 눈가림, 위약-대조, 평행군 3상 슬롯사이트시험계획을 승인받았다.
이번 연구는 국내 환자 45명(글로벌 명)의 참여를 목표로 △서울아산병원 △가톨릭대 서울성모병원 △연세대 의대 세브란스병원 △서울대병원 △고려대 의대부속안산병원 △조선대병원 △경북대병원 △건국대병원 △아주대병원 △양산부산대병원 △가톨릭대 인천성모병원 △강동경희대 의대병원 등 의료기관에서 2026년 9월까지 진행될 예정이다.
연구진은 이번 연구의 1차 유효성평가변수를 '손발 슬롯사이트시험자 전반적 평가(Hand and Foot Investigator Global Assessment, HF-IGA) 점수 0 또는 1을 달성하고, 베이스라인 대비 2 점 이상 개선된 시험대상자의 비율'로 설정했다. 점수가 높을수록 질병 중증도가 더 심한 것을 의미한다.
또, 2차 유효성평가변수로 △베이스라인에 HF-최대 가려움증 수치평가 점수(NRS)가 4 점 이상이고, 베이스라인 대비 4 점 이상의 감소(개선)를 달성한 시험대상자 비율 △아토피성 손 피부염 병변 소실 만족도(Atopic Hand Dermatitis Clearance Satisfaction, AHDCS)에 대해 '만족'또는 '매우 만족'을 나타낸 시험대상자 비율 등으로 설정했다.
한편, 한국릴리는 작년 8월 엡글리스를 허가 받고, 올해 1월 8일에는 시장에 출시한 바 있다. 식약처는 엡글리스를 성인 및 12세 이상 청소년(체중 40kg 이상)에서 국소치료제로 적절히 조절되지 않거나 이들 치료제가 권장되지 않는 중등도에서 중증의 아토피피부염 치료제로 허가했다. 16주 투여 후 슬롯사이트 반응을 달성한 경우 유지 용량(250mg)을 4주마다 투여할 수 있다.
엡글리스 단독 요법을 평가한 3상 슬롯사이트 'ADvocate-1', 'ADvocate-2' 연구에서, 엡글리스군은 유도기간(0~16주) 동안 EASI(Eczema Area and Severity Index, 이하 EASI) 75가 각각 58.8%, 52.1%(위약군 16.2%, 18.1%), EASI 90이 각각 38.3%, 30.7% (위약군 9%, 9.5%)로 위약군 대비 개선을 보였다(p<0.001).
1년 간 유지요법 후(52 주차) 엡글리스군의 EASI 75 도달률은 81.7%(p<0.05, 위약군 66.4%), EASI 90 도달률은 66.4%(p<0.01, 위약군 41.9%)까지 증가하며 장기 치료에서도 유의미한 증상 개선을 확인한 바 있다.
