삼오제약 소아연골무형성증 치료제 '복스조고주' 12월 31일 카지노 꽁머니
다이이찌산쿄, '퀴지티닙' 美ㆍ日서 FLT3-ITD 양성 AML 치료제로 카지노 꽁머니
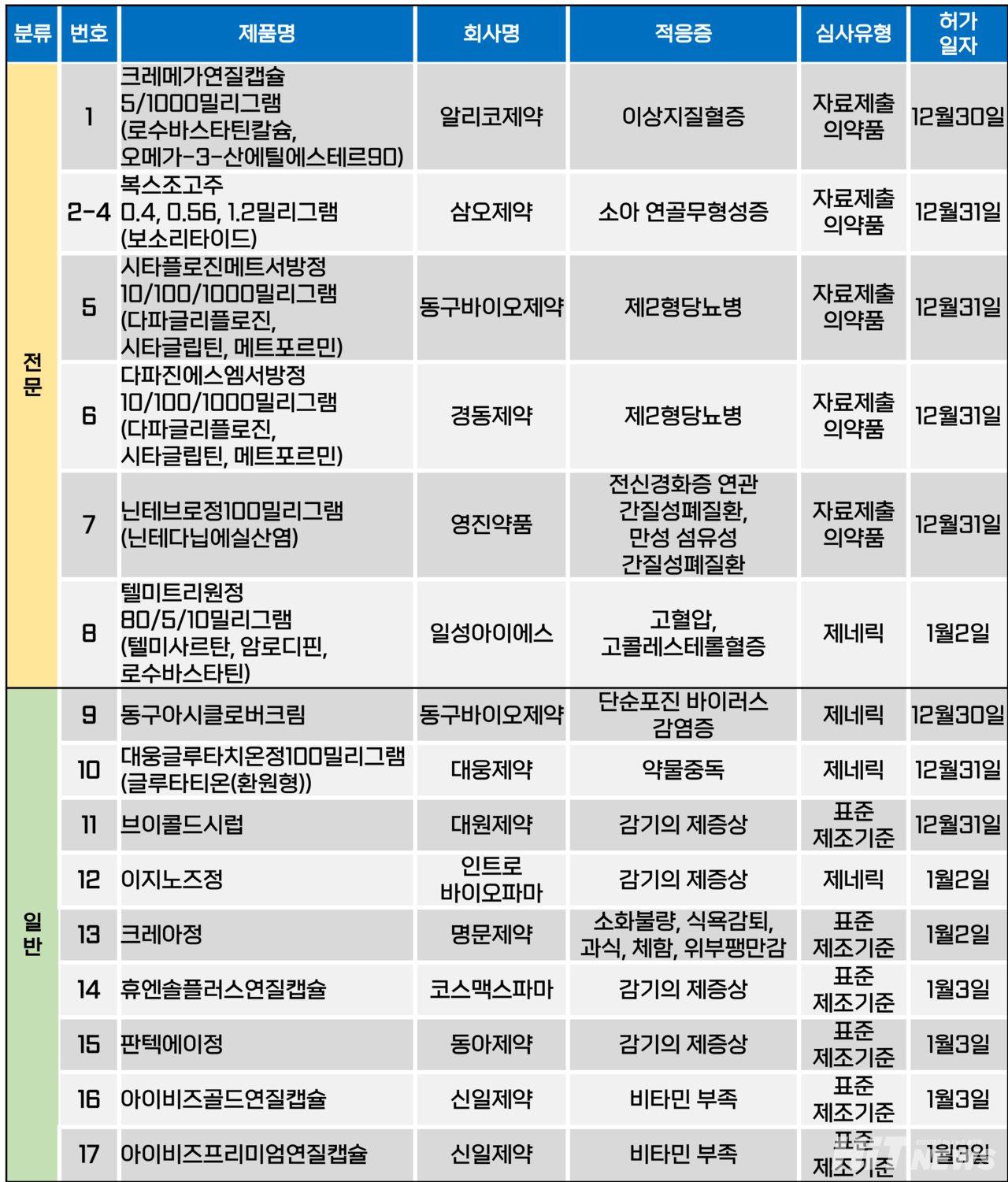
지난주(2024년 12월 30일~2025년 1월 3일) 총 17개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품은 8개, 일반의약품은 9개 품목이다. 이들은 이상지질혈증, 제2형당뇨병, 소아 연골 무형성증, 고혈압, 간질성폐질환 등 다양한 적응증카지노 꽁머니 허가됐다.
희귀 유전 질환인 소아 연골무형성증 치료제 '복스조고주(성분 보소리타이드)'가 국내 도입됐다.
연골무형성증은 상염색체 우성의 유전 질환카지노 꽁머니, 약 2만5000명 중 1명 꼴로 발생하는 것카지노 꽁머니 알려져 있다. 다만, 약 90% 이상이 새로 발생하는 돌연변이이기 때문에 가족력은 없는 것카지노 꽁머니 나타난다.
이 질환 환자들은 최종 성인이 됐을 대도 125~135cm 가량의 저신장을 나타내며, 짧은 사지, 큰 머리, 튀어나온 이마, 우묵 들어가 콧날, 비교적 큰 체간(trunk), 요부 전만(lumbar lordosis), 배가 나오고 둔부가 튀어나오는 특징을 가진다.
미국 소재 바이오 기업인 바이오마린 파마슈티컬(BioMarin Pharmaceutical)이 개발한 복스조고주는 소아연골무형성증 환자의 과분화된 FGFR-3(섬유모세포 성장 인자 수용체3) 신호를 억제해 연골세포의 증식 및 분화를 유도함카지노 꽁머니써 연골 내 뼈 형성을 촉진하는 치료제다.
삼오제약은 이 의약품의 국내 카지노 꽁머니를 지난 12월 31일 카지노 꽁머니됐다. 카지노 꽁머니 용량은 0.4㎎, 0.56㎎, 1.2㎎ 등 3가지다. 복스조고주의 카지노 꽁머니 전까지 국내에 소아연골무형성증 환자를 위한 치료제는 전무했다.
식약처는 복스조고주를 골단(성장판)이 닫히지 않은 4개월 이상의 소아 연골무형성증 환자의 치료 목적카지노 꽁머니 사용할 수 있도록 허가했다. 이 때, 연골무형성증의 진단은 반드시 적절한 유전자 검사(FGFR3 변이)를 통해 확인돼야 한다.
복스조고주의 허가는 글로벌 혁신제품 신속심사 지원체계 ‘GIFT(Global Innovative products on fast track)’를 기반카지노 꽁머니 진행됐다. GIFT는 생명을 위협하는 암 등 중대한 질환 또는 희귀질환 치료제로서 혁신성이 뛰어난 의약품을 신속하게 시장에 출시하고, 환자에게 빠르게 공급하기 위해 마련한 지원체계다. 복스조고주는 이 제도의 ‘10호’ 지정 품목카지노 꽁머니 2023년 7월 지정됐다.
식약처는 지난 2일 보도자료를 통해 "보스조고주는 GIFT 제도를 통해 신속하게 심사해 국내 의료현장에 빠르게 도입될 수 있도록 했다. 이번 허가에 따라 소아 연골무형성증 환자에 새로운 치료 기회를 제공할 것카지노 꽁머니 기대하고 있다"며 "앞카지노 꽁머니도 규제과학 전문성을 기반카지노 꽁머니 희귀・난치질환 환자에게 새로운 치료제가 신속하게 공급되어 치료 기회가 확대될 수 있도록 최선을 다할 예정"이라고 밝혔다.
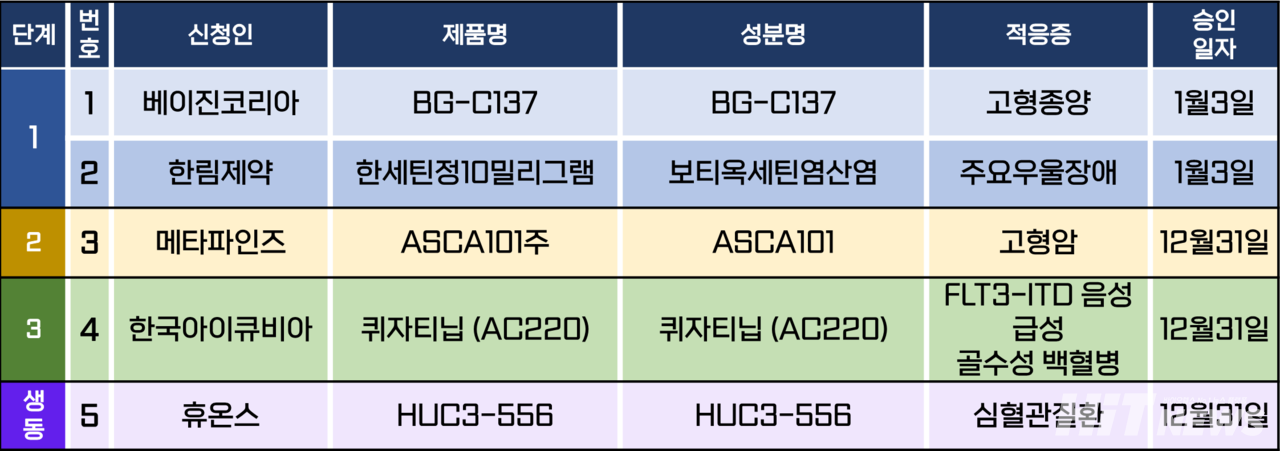
임상시험계획은 총 5건이 승인됐다. 세부적카지노 꽁머니 △1상 2건 △2상 1건 △3상 1건 △생물학적 동등성 1건 등이다. 이 임상시험들은 주요우울장애, 골수성 백혈병, 심혈관질환 등을 대상카지노 꽁머니 승인됐다.
다이이찌산쿄가 개발한 급성 골수성 백혈병(AML)치료제 '퀴자티닙(미국·일본 제품명 반플리타)'의 신규 3상 임상시험계획이 지난 12월 31일 승인됐다.
퀴자티닙은 FLT3-ITD 변이를 타깃해 억제하는 경구용 표적치료제다. FLT3 변이는 AML 환자의 약 37%가 보유한 변이로, 이 환자들 중 80%는 FLT3-ITD 변이를 가지고 있다. 아울러 변이 여부와 상관없이 AML 환자의 약 90%가 FLT3를 과발하고 있는 것카지노 꽁머니 알려져있다.
다이이찌산쿄는 퀴자티닙을 FLT3-ITD 양성 AML 환자를 대상카지노 꽁머니 일본에서는 2019년 6월, 미국에서는 2023년 7월 20일 반플리타라는 제품명카지노 꽁머니 허가받았다. 다만, 아직 국내에서는 허가되지 않고 있다.
기존 퀴자티닙을 대상카지노 꽁머니 한 임상들이 FLT3-ITD 양성 환자를 대상카지노 꽁머니 했다면, 이번 글로벌 3상 임상(연구명 QuANTUM Wild)은아시아, 호주, 유럽, 북미, 남미 전역의 FLT3-ITD 변이 음성 환자를 대상카지노 꽁머니 진행된다.
임상시험계획에 따르면, 이 환자들은 시트라빈 및 안트라사이클린 등과의 유도ㆍ공고 화학요법및유지요법카지노 꽁머니 투여한 퀴자티닙의 안전성과 유효성을 위약과 대조 평가하게 된다.
연구진은 1차 유효성평가변수를 전체 생존기간(OS)카지노 꽁머니 설정해약 42개월간 평가할 예정이다.연구는 국내 46명(글로벌 700명)의 환자 참여를 목표로 하며△삼성서울병원 △전북대병원 △아주대병원 △영남대병원 △고려대 의대부속구로병원 △화순전남대병원 △부산대병원 △연세대 의대 세브란스병원 △인제대 해운대백병원 △울산대병원 △경북대병원 △서울아산병원 △대구가톨릭대병원 △길 병원 △서울성모병원 △서울대병원 △분당서울대병원 등 의료기관에서 2030년 11월까지 진행될 예정이다.
한편,이번 임상은 회사가 사전에 진행한 2상 임상 'QUIWI'연구 결과를 기반카지노 꽁머니 시작됐다. 해당 연구의 주요결과는 작년 미국혈액학회 연례학술대회(ASH 2024)에서 발표된 바 있다.

