2023년 누보로젯 출시 후 2년 6개월 만…173억 4제 시장 본격 드라이브
면역항암제 '테빔브라', 식도암 수술 후 항암보조요법 3상 카지노 뽀찌 승인
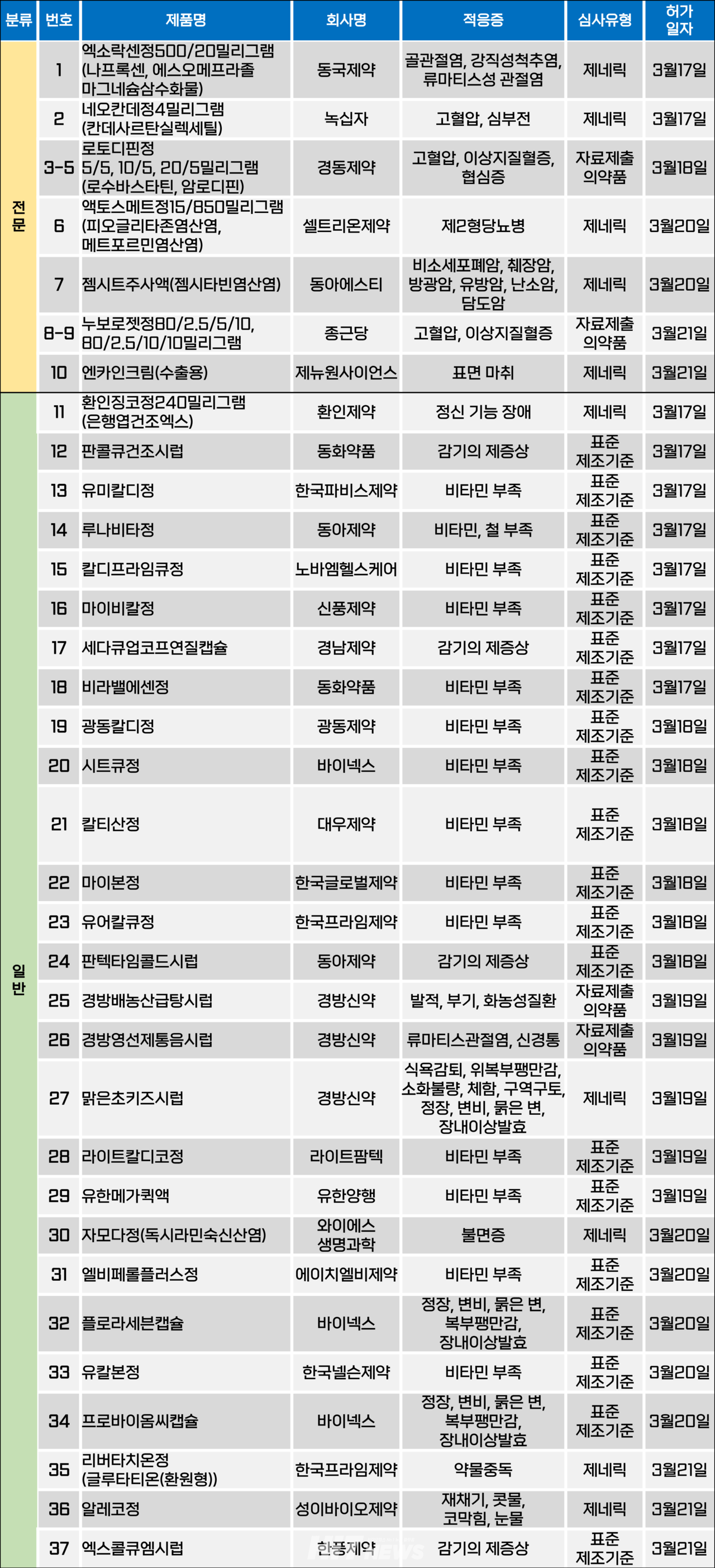
지난주(3월 17~21일) 총 37개 품목이 식품의약품안전처에서 품목카지노 뽀찌를 받았다. 전문의약품은 10개, 일반의약품은 27개 품목이다. 이들은 고혈압, 이상지질혈증, 협심증, 제2형당뇨병, 관절염 등 적응증으로 카지노 뽀찌됐다.
종근당이 개발한 고혈압 및 이상지질혈증 치료 4제 복합제 ‘누보로젯(성분 텔미사르탄+S-암로디핀+로수바스타틴+에제티미브)’의 용량군이 확대됐다.
회사는 지난 21일 식약처로부터 누보로젯의 80/2.5/5/10, 80/2.5/10/10㎎ 용량 품목을 카지노 뽀찌 받았다. 이번 카지노 뽀찌로 누보로젯은 기존 40/2.5/5/10, 40/2.5/10/10, 40/5/5/10, 40/5/10/10㎎ 등 4개 용량에서 총 6개로 용량군이 확대됐다. 2022년 7월 최초 카지노 뽀찌된 지 약 2년 6개월 만이다.
과거 업계 관계자들은 카지노 뽀찌 현장에서 전문의들의 처방 경험이 축적됨에 따라, 4제 복합제 규모가 더욱 성장할 것으로 전망한 바 있다. 이에 보령과 대웅제약 등 중견제약사도 자사가 보유한 고혈압 및 고지혈증 치료제를 기반으로 4제 복합제 개발을 위한 카지노 뽀찌시험을 진행 중이다.
최근 가파른 성장세를 보이고 있는 고혈압 및 이상지질혈증 4제 복합제 시장이 그 규모를 2년 새 100억원 가까이 불리면서, 종근당도 본격적인 시장 점유율 확대에 드라이브를 건 것으로 해석된다.
의약품 시장조사기관 유비스트(UBIST)에 따르면, 고혈압ㆍ고지혈증 4제 복합제들의 전체 원외처방액은 2022년 67억1768만원에서 2024년 173억1552만원으로 성장했다.
현재 이 시장은 누보로젯을 포함해 5개 제품이 경쟁하고 있다. △한미약품 '아모잘탄엑스큐(성분 로사르탄+에제티미브+암로디핀+로수바스타틴)' △녹십자 '로제텔핀(성분 텔미사르탄+에제티미브+암로디핀+로수바스타틴)' △유한양행 '듀오웰에이플러스(성분 텔미사르탄+에제티미브+암로디핀+로수바스타틴)' △제일약품 '텔미칸큐(성분 텔미사르탄+에제티미브+암로디핀+로수바스타틴)' 등이다.
이 중 시장의 약 73%를 점유하고 있는 선두 제품은 아모잘탄엑스큐다. 이 제품의 원외처방액은 2023년 104억8326만원에서 작년 126억8033만원으로 약 21%의 성장하는 등 성장을 이어가고 있다.
2023년 1월 출시한 누보로젯의 성장세도 가파르다. 원외처방액이 2023년 약 9억8033만원에서 2024년 18억1075만원으로 2배 가까이 커졌다.
한미약품은 아모잘탄엑스큐의 용량 라인업을 6개까지 구축하며 기존 시장을 선도해왔다. 종근당 또한 치료 옵션을 추가함에 따라, 누보로젯의 시장 점유율을 얼마나 끌어올릴 수 있을 지 주목된다.
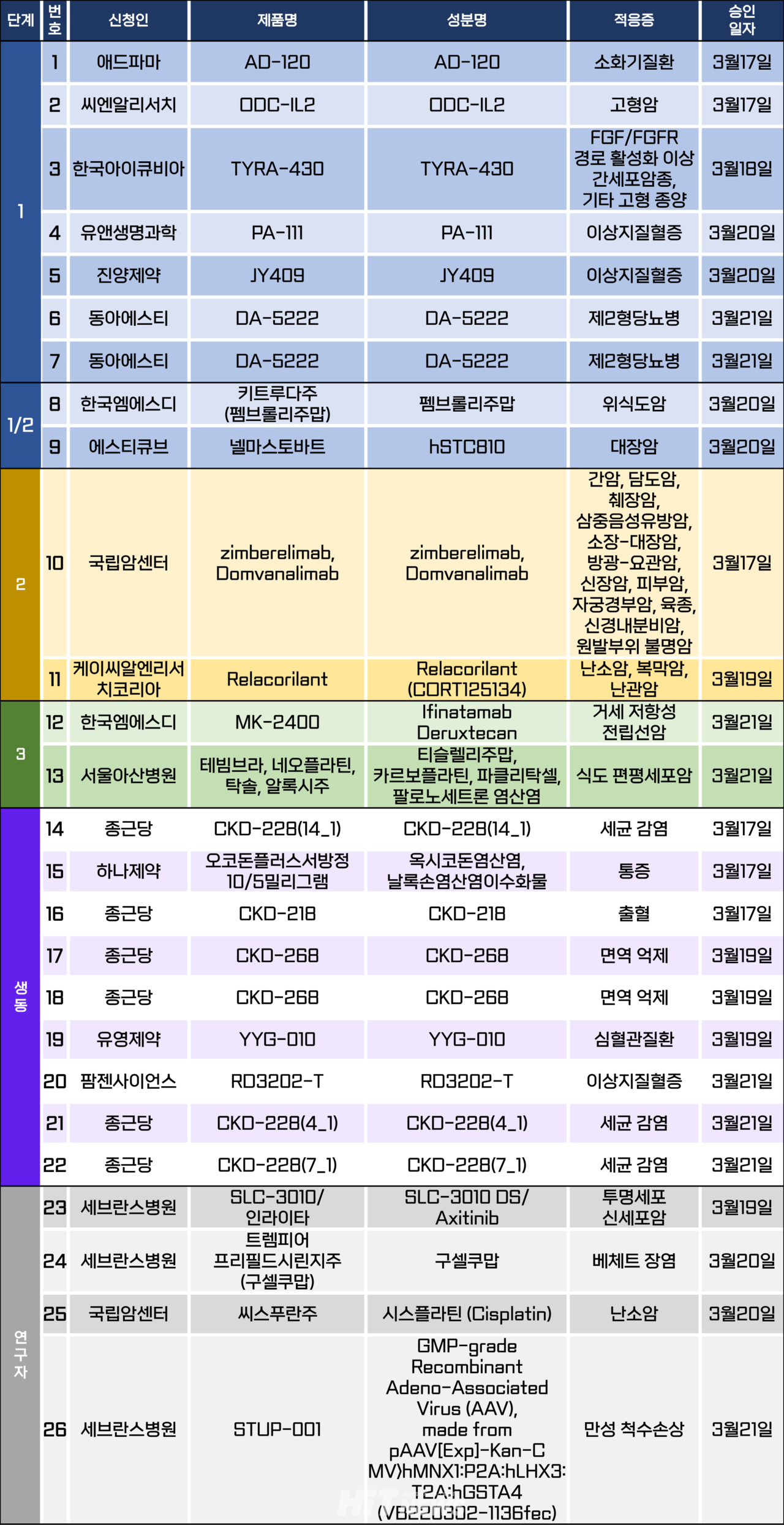
카지노 뽀찌시험계획은 총 26건이 승인됐다. 세부적으로 △1상 7건 △1/2상 2건 △2상 2건 △3상 2건 △생물학적 동등성 9건 △연구자카지노 뽀찌 4건 등이다. 이 카지노 뽀찌시험들은 고혈압, 이상지질혈증, 제2형당뇨병 등 질환과 식도암, 대장암, 삼중음성유방암, 전립선암 암종을 대상으로 승인됐다.
베이진이 개발한 면역항암제 '테빔브라(성분 티슬리주맙)'의 사용 범위를 식도암 수술 후 보조항암요법으로 넓히기 위한 국내 3상 카지노 뽀찌시험이 진행된다.
서울아산병원은 지난 21일 근치적 절제된 국소 진행성 식도 편평세포암 환자를 대상으로 한 순환 종양 DNA 미세잔존암(MRD) 기반 보조항암요법에서 테빔브라의 안전성 및 유효성을 평가하기 위한 무작위 배정, 오픈라벨 3상 카지노 뽀찌시험계획을 승인받았다.
테빔브라는 항 PD-1 항체 기반 면역항암제로, 미국 및 유럽 등 글로벌 시장에서 절제 불가능 또는 전이성 식도 편평세포암 환자의 1차 치료제로 카지노 뽀찌돼 사용되고 있다. 국내에서는 2차 치료제로만 카지노 뽀찌된 상황이다.
이번 카지노 뽀찌시험은 국내 172명 환자 참여를 목표로, 2034년 12월까지 △서울아산병원 △서울대병원 △세브란스병원 △분당서울대병원 △아주대병원 등 5개 의료기관에서 진행된다. 통상 글로벌 규모로 진행되는 3상 카지노 뽀찌과 달리 이번 연구는 국내에서만 진행된다.
연구진은 선행 항암-방사선 병용요법 없이 수술(upfront surgery)을 받은 환자는 보조 화학방사선면역요법(Chemoradioimmunotherapy)을, 수술 전 병용요법을 받은 환자는 보조 화학면역요법(Chemoimmunotherapy)을 시행한다.
테빔브라와 함께 병용으로 투여되는 약제는 항암화학요법제인 '네오플라틴(성분 카르보플라틴)'과 '탁솔(성분 파클리탁셀)'이며, 항구토제인 '알록시주(성분 팔로노세트론 염산염)'도 함께 사용된다.
연구의 1차 유효성평가변수는 ‘연구자가 평가한 무재발생존(RFS by investigator)’이며, 2차 유효성평가변수는 △전체생존(OS) △원격 전이 없는 생존(Distant metastasis-free survival) △국소-구역 무재발생존(Locoregional RFS) △최초 재발 패턴 (Pattern of first recurrence) △NCI-CTCAE v5.0에 따른 이상사례의 발생률 및 중증도(The incidence and severity of adverse events) △ 환자보고결과(PRO)로 측정한 건강 관련 삶의 질(HRQoL) △치료 유효성 예측 및 예후 예측 바이오마커로서의 ctDNA 수치 등이다.
한편, 테빔브라는 지난 4일(현지시간) 미국 식품의약국(FDA)로부터 PD-L1 발현 양성(≥1%) 식도암 환자의 1차 치료제로 백금 기반 항암화학제 병용요법으로 사용할 수 있도록 카지노 뽀찌된 바 있다.
허가는 3상 카지노 뽀찌인 'RATIONALE-306'연구 결과를 바탕으로 이뤄졌다. 연구 결과, 테빔브라 투여군의 생존 기간 중앙값(mOS)은 16.8개월로, 위약군 9.6개월 대비 유의미한 개선을 보였다. 이는 위약 대비 사망 위험을 34% 감소시킨 결과다(HR: 0.66, [95% CI: 0.53, 0.82]).
회사는 작년 한 해에만 미국 FDA로부터 식도 편평세포암 2차 단독요법, 위암 및 위식도접합부암 1차 항암화학제 병용요법 등 3개 적응증에 대한 허가를 획득했다. 이 외에도 HER2 양성 위암 환자를 대상으로 한 HERIZON-GEA-01 3상 카지노 뽀찌시험을 진행하는 등 적응증 확대에도 박차를 가하고 있다.

