신속 심사 제도 병행 시 허가 가능성 높아...CMC 충족은 필수

국내 제약·바이오 기업들의 신약 파이프라인이 미국 식품의약국(FDA)에서 희귀카지노 토토으로 지정되는 사례가 증가하고 있으나,아직희귀카지노 토토지정이신약 허가로 이어진사례는 나오지 않았다.
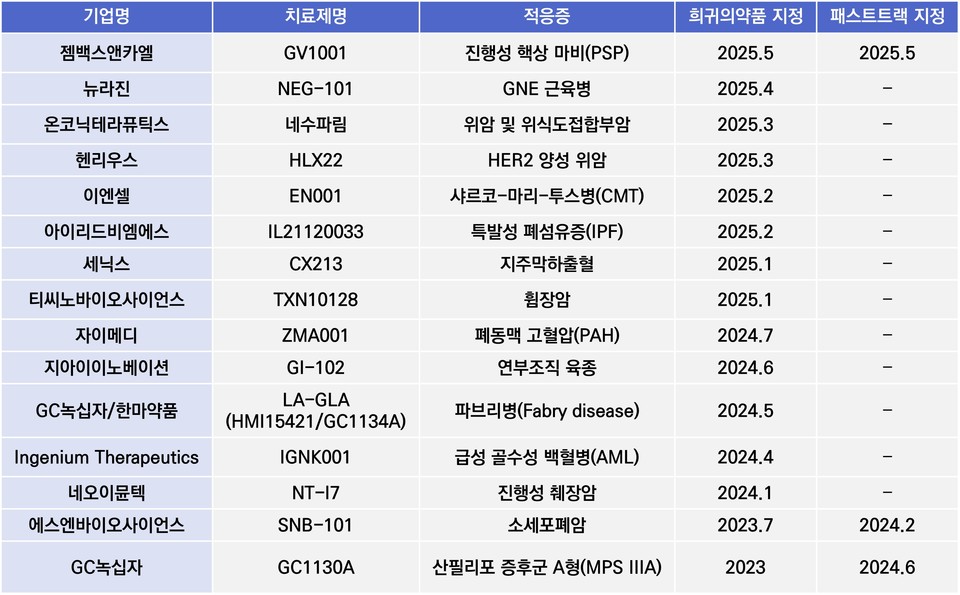
19일 업계에따르면 국내 기업 중 GC녹십자, 온코닉테라퓨틱스, 이엔셀, 젬백스 등 여러 기업이 FDA에서희귀카지노 토토 지정을 받았지만, 대부분 임상 1상 또는 2상 단계에 머물러 있다.
FDA는 희귀카지노 토토법 제정 이후 2023년까지 총 5162건의 희귀카지노 토토 지정을 승인했다. 이 중 신약 허가에 도달한 사례는 882건으로 약 17% 확률이다.희귀카지노 토토 지정이 곧 허가를의미하지는 않는다는 것을 보여준다.
관련 업계에서는 단순히 희귀카지노 토토 지정을받았는지를 넘어, 실제 허가로 이어질 수 있을지 판단할 수 있는 보조 지표들을 함께 검토할 필요가 있다는 의견이 나온다. 미국 희귀카지노 토토정책센터(NORD)와 FDA는 패스트트랙, 첨단재생치료제(RMAT), 희귀소아질환지정(RPD) 등 병행 지위가 부여된 경우 허가 전환율이 상대적으로 높다고 분석했다.
국내 기업 중 아직 허가까지 이어지지 않았지만젬백스의 'GV1001'과 에스엔바이오사이언스의 'SNB-101',GC녹십자의 'GC1130A'가 희귀카지노 토토과 패스트트랙 지위를 동시에 획득했다.
실제로 미국 FDA 산하 카지노 토토평가연구센터(CDER)가 지난해 발표한신약 승인 통계에 따르면, 같은 해 승인된 신약50건 중 절반 이상인 26건이 희귀카지노 토토 지정을 받았고, 이 중 상당수는 패스트트랙, 혁신신약 등신속심사 제도를 함께적용받았다.
미국 의약전문지 RAPS도 이와 유사한 분석을 내놨다.지난해 FDA 허가 신약 중 66%가 최소 하나 이상의 신속심사 프로그램을 활용했다고 분석하며, 이러한 제도 병행이 실질적인 허가 전환률을 높이는 데 기여한다고 보도했다.실제로 2017년부터 2022년 사이 허가된 희귀카지노 토토 중 52%가혁신 신약으로 동시지정됐으며, 이 중 60%는 패스트트랙 또는 가속 승인 제도가 함께 적용됐다.
희귀카지노 토토이 신약 허가로 이어지는 또 다른 주요 변수는 CMC(화학·제조·품질) 요건 충족 여부다. CBER는 지난해 발간한 신약 통계 보고서에서 세포·유전자 치료제 등 바이오카지노 토토의 경우 FDA에서 제조 일관성 확보와 배치 간 품질 재현성을 엄격히 평가한다고 밝혔다. 이에실제 심사 과정에서 이와 관련된 보완요구가 빈번하게 발생하며,특히 상업 생산 체계를 임상 단계에서부터 구축하지 못한 경우 허가 일정이 수년 단위로 지연될 수 있다고 말했다.

