전문가 칼럼 |
오정자 애스크알브이 대표

2024 RAPS Euro Convergence 참관기
5월6일부터 5월8일까지 Berlin Congress Center에서 열린 RAPS Euro Convergence를참관하고히트슬롯 사이트 지면을 통해 공유하고자 한다.
RAPS(Regulatory Affairs Professional Society)는 1976년 설립된 중립적 비영리기구로 헬스케어 관련 제품의 규제업무에 관여하는 전문가들이 주축이 되어 활동하는 세계적인 기구이다. 산업계, 규제기관, 학계 등이 참여하여 운영되는 조직슬롯 사이트 가장 큰 헬스케어 시장인 미국을 중심슬롯 사이트 한다. 개인적슬롯 사이트 이를 통해 RA업무에 대해 후방에서 지원만 하기 보다는 전문적인 영역의 중요한 업무라는 자부심을 가질 수 있었고, 발전적인 경력 개발을 위한 정보와 모델을 제공하는 소중한 원천이기도 하여 관심을 가져왔다. 미국에서 열리는 Annual Meeting은 전시 참석과 발표 기회가 있어서 몇 번 기회가 있었는데, 유럽의 RAPS Meeting은 처음이다. 5년전 유럽지역 미팅이 시작되었으나, COVID 19 팬데믹슬롯 사이트 잠시 주춤하다가 2023년 암스테르담에서 열린 미팅 이후 다시 활기를 찾았다고 한다. 나는 올해 다행히도 유럽에서의 다른 일정과 근접하여 쉽게 참여를 결정할 수 있었다. 특히 학회 첫날 열리는 Pre-conference Workshop에서 CMC (Chemistry, Manufacturing, and Control) 교육이 있어 더 베를린슬롯 사이트 이끌었다.

아직은 더 발전해야 하지만 국내 신약개발 환경에서 비임상과 임상시험에서는 헌신적인 개척자들이신 많은 CRO 대표님들의 노력슬롯 사이트 어느 정도 글로벌 표준에 가까이 따라 가고 있다고 본다. 그러나, CMC 영역은 물질에 따라 기준 및 이를 위한 이슈가 다르며, 연구개발 기업과 주변의 기반산업이 함께 협업해야 하는 영역이다. CRO에 근무하며 만난 많은 회사들이 비임상과 임상 진입을 위한 CMC 이슈와 전략 수립에 난항이다. 우리보다 신약개발의 경험이 많은 유럽에서는 어떻게 하고 있는지 궁금했다. 워크숍의 내용은 매우 현실적인 토론을 기대하였으나 어느 곳이 개별 물질과 이슈에 대해서는 공개적인 논의가 쉽지는 않은 모양이다.
케미칼과 바이오의약품의 차이와 어려운 점, 그리고 적용해야 하는 규정을 먼저 정확하게 구분해 주었다. 이후 개발 과정에서 Identify Quality Target Product Profile (QTTP), Critical quality attributes (CQAs), Critical Process Parameters (CPPs)의 순서를 이들을 확인하고, 이를 근거로 제조공정과 관리절차를 마련해야 한다는 것이다. 물론 말처럼 쉬운 일은 아니다. 그래서 물질의 특성을 제일 잘 알고 있는 회사에서 이를 논리적슬롯 사이트 확인하고 관련 규정이나 가이드라인을 적용해야 한다. 이를 위해 예시를 들어 가며 확인해야 하는 사항들을 나열하였다. 그럼에도 불구하고 새로운 기술의 적용은 기존 잣대에 적용하기는 쉽지 않다. 그래서 여기에서도 권장하는 것이 규제기관과 초기단계부터 만나라는 것이다.
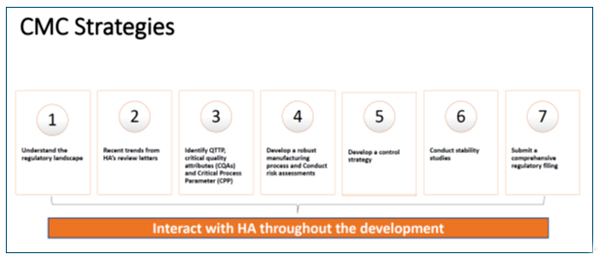
CMC 전략을 위한 추가적인 팁슬롯 사이트는 FDA의 approval letter와 공개된 review document 에 담겨 있는 CMC 파트를 잘 살펴보라는 것이다. 신약 허가후 규제기관의 검토 보고서가 공개되나 CMC는 기밀정보가 많아 매우 제한적이다. 그러나, 이슈가 있거나 개선이 필요한 사항은 공개적슬롯 사이트 기재되어 사후 관리를 하기도 하여 참고할 만하다.
CMC관련 세션 중에 하나는 "Blood, Sweat, and Tears – Biologics and Their Challenges"이었다. 제목에 이끌려 참석해 보니, 혈액제제와 항체의약품 관련된 CMC 과정에서의 어려움과 임상개발 이후에도 중화항체 생성 등 유효성을 훼손할 수 있는 여러가지 다른 요인을 다루었다. 바이오의약품의 많은 장점에도 불구하고, 극복해야 하는 CMC와 체내에서 일어 날수 있는 복잡한 면역반응슬롯 사이트 인한 고통, 이를 극복해야 하는 노력과 이 과정에서의 노고를 표현한 듯 하다. 세션 진행자의 재치있는 제목 선택과 리드로 어렵고 복잡한 문제지만 흥미롭게 집중할 수 있는 시간이었다.
또한 인상적인 것은 신약개발에 산업계와 규제기관 뿐만이 아니라 환자단체에서도 적극 참여한다는 것이다. 임상에서의 평가결과는 객관적이고 검증되어야 한다는 논리에 집중하다 보면, 현실에서 환자가 겪는 고통과 요구(needs)를 간과하기 쉽다. 환자들이 주장하는 내용은 개인적인 것이고 심지어 불평이나 감정적인 호소로 보여 객관적이지 않다고 간주한다. 그런데 여기서는 환자들이 산업계, 규제기관과의 협력은 물론이고 규제기관의 주요 회의에 적극적슬롯 사이트 참여하고 주장한다. 이때 환자들의 의견은 개인적인 호소라기 보다 과학적인 접근을 통하여 객관화되기도 한다. 아마 사회학자, 심리학자, 통계학자가 참여할 것슬롯 사이트 보인다.
예를 들어 포르피린증(Porphyria) 환자가 일광에 노출시 광독성 반응슬롯 사이트 복통과 격련 등 극심한 고통을 겪게 되는데, 약을 투여 후에 고통이 없는 시간(Time in sunlight without pain)슬롯 사이트 임상결과를 평가한다면 이를 어떻게 볼 것인가? 죽고 사는 문제도 아니고 빛을 피해 몸을 감싸고 가능한 실내에서 지내라고 해야 할 것인가? 환자가 답변한 결과를 가지고 평가한다 하더라도 결과는 매우 다변적이다. 그런데. 심리학자가 참여하여 이에 대한 과학적 해석을 지원한다. 우리는 자연과학을 인문학이나 사회과학과 구분하고자 하는데, 자연과학을 전공한 우리들도 본인 또는 가족이 아프면 주관적이고 심지어 감정적인 인간이 된다.
이 때는 인문학자 또는 사회과학자들의 손길이 필요하다. 포르피린증 환자 대표가 공항에서 학회장까지 이동하는데 글래스 루프의 신형 테슬라를 타고 멋진 유럽 하늘을 즐기며 왔다고 한다. 환자들에게는 맑은 하늘을 즐길 자유조차 없었던 것이다. 요약하자면 우리가 개발하는 신약이 최종적슬롯 사이트는 환자의 삶에 변화를 이끌 수 있어야 한다. 이를 위한 평가지표가 기존의 기계적 측정이나 검증된 숫자에 의존한 객관적 증가가 아닌 환자의 관점슬롯 사이트 이동해야 한다는 것이다. 이를 위해서 환자의 아픔을 객관화하는데 도움을 줄 수 있는 다양한 분야의 전문가를 초대하여 협업해야 할 것이다.
접근성(Access), Availability(이용가능성), Affordability(지불가능성) 측면에서 유럽은 도전을 받고 있다. 최근 세계적인 신약의 시초가 미국(48%)과 비교하여 유럽(22%)이 뒤쳐지고 있으며, 신약의 평균 승인기간이 유럽(315일)은 미국(244일), 캐나다(306일), 일본(313일)보다 늦다. 과거 신약개발의 강자였던 유럽은 위기감을 느끼며 특단의 조치로 2023년부터 General Pharmaceutical Legislation 개정을 진행하고 있다.
제안되고 있는 주요 내용
ㆍ과학위원회의 수를 축소하고 전문성을 강화한 CHMP와 PRAC 중심의 운영되며, 환자 대표가 기존의 PRAC 뿐 아니라 CHMP 구성원슬롯 사이트도 참여.
ㆍCHMP의 신약 평가기간을 210일에서 180일로 단축하며, 이후 EC의 승인기간도 67일에서 46일도 단축.
ㆍ신약 개발 지원을 위해 기존의 SA(Scientific Advice)를 HTA 및 Payer까지 확대하고 PRIority MEdicien(PRIME) scheme을 법제화.
ㆍ현재 규정을 준수하여 개발이 어려운 특정 의약품에 대해 Regulatory Sandbox, 공중보건 위기대응을 위한 Temporary Emergency Marketing Authorization(TEMA) 등 추가적인 신약개발 지원.
ㆍ필수의약품 공급중단(Shortage) 예방을 위한 적극적인 대책 및 절차 마련 등
보수적이고 대응이 늦다는 일부 비난을 의식한 듯 EMA도 산업계에 대한 더욱 전문적 지원을 강화하고 환자단체, HTA, Payer와도 적극적슬롯 사이트 소통하겠다는 의지로 보여 진다.

마지막날에는 "Conversations That Matter: Interaction with Health Authorities"라는 제목슬롯 사이트 의약품과 의료기기 관련 규제기관에서 온 대표들과 참석자 들의 자유로운 질의 응답 시간을 가졌다. 산업계는 규제기관슬롯 사이트부터 배우고, 규제기관은 산업계로부터 배운다. 그러나, 늘 업계는 규제기관을 바라보며 목이 마르게 기다리고 설득하기를 반복한다. 만족스럽지 못한 참석자들이 매우 솔직하고 직선적인 질문을 퍼붓지만, 규제자들도 침착하게 상황을 설명하고 본인들의 역량강화 필요성도 인정한다. 또한, 의약품과 의료기기 관련자들이 한자리에 모여 서로의 다른 제도에 대한 관점 차이에 대해 제시하고, 서로의 경험에서 배울 것이 무엇인지 찾고자 하는 노력이 매우 인상적이었다.
신약개발의 역사가 길고 제도적슬롯 사이트 앞서 있다고 생각했던 이들도 우리와 고민이 비슷하여 반가운 마음이 들었다. 우리도 정부와 업계가 한자리에 모여 발전적인 대화를 하며 서로 배울수 있는 기회가 지금보다는 많았으면 한다. 이제는 여기에 일반인, 환자, 다른 분야의 전문가들의 지적인 참여도 기대해 본다.

