4월 정기회의 개최...유전성 아밀로이드증 등 미충족 영역 치료제 검토

유럽의약품청(EMA) 산하 의약품사용자문위원회(CHMP)는 지난 4월 정기회의를 열고 총 16개의 신약에 대해 시판 허가(Opinion)을 온라인카지노했다. 이번 회의에서는 낭포성 섬유증, 유전성 아밀로이드증, 듀센형 근이영양증, 중증 갑상선 안병증 등 다양한 미충족 수요 영역을 겨냥한 치료제들이 대거 포함돼 주목된다.
관련온라인카지노 :
구체적으로 보면 '알리프텍(Alyftek, 성분명: 듀티바카프터/테자카프터/반자카프터)'가 허가 온라인카지노됐다.6세 이상 낭포성 섬유증 환자를 대상으로 하는 혁신적 3제 복합 요법이다. 또한, 희귀 유전질환인 유전성 트랜스티레틴 아밀로이드증 치료제 앳트로지(Attrogy, 성분명: 디플루니살) 역시 일반 시판 허가 온라인카지노를 받았다.
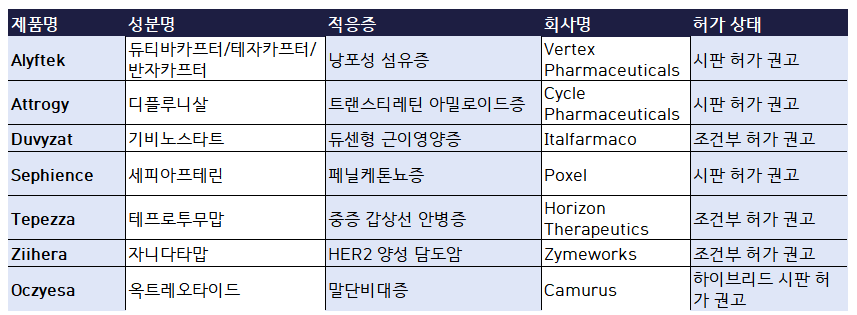
'두비잣(Duvyzat, 성분명: 기비노스타트)'보행이 가능한 6세 이상 듀센형 근이영양증(DMD) 환자를 위한 치료제로, 조건부 시판 허가가 온라인카지노됐다. 이 외에도 페닐케톤뇨증(PKU) 환자의 고페닐알라닌혈증 치료제 '세피언스(Sephience, 성분명: 세피아프테린)'와 중등도에서 중증의 갑상선 안병증(TED)을 대상으로 '테페자(Tepezza, 성분명: 테프로투무맙)'는 조건부 허가가 각각 온라인카지노됐다.
고형암 영역에서도 새로운 치료제가 등장했다. HER2 양성 담도암 환자에게 사용되는 '지헤라(Ziihera, 성분명: 자니다타맙)'는 절제 불가능한 국소 진행성 또는 전이성 환자에 대한 조건부 허가 온라인카지노를 받았다. 또한, 말단비대증 치료에 사용되는 하이브리드 의약품 '옥지에사(Oczyesa, 성분명: 옥트레오타이드)'도 허가온라인카지노 목록에 포함됐다.
이번 회의에서는 신약 온라인카지노 외에도 10개 기존 의약품의 적응증 확장도 함께 승인됐다. 대표적으로 면역항암제, 백신, 혈액암 치료제 등이 기존 적응증 외 새로운 암종 또는 투여 경로에 대해 추가 사용 가능성을 확보했다.
반면, 일부 품목은 부정적 온라인카지노 또는 신청 철회를 통해 시장 진입이 보류됐다. EMA는 이에 대해 과학적 데이터 부족, 안전성 우려 등의 사유를 밝혔다.
EMA CHMP의 이번 온라인카지노는 향후 유럽연합집행위원회(EC)의 최종 승인 절차를 거치게 되며, 승인 시 유럽 전역에서 해당 치료제의 상용화가 가능해진다. 특히 이번 회의는 희귀질환 및 고난도 치료영역의 신약들이 다수 포함되며, 유럽 내 환자들의 치료 접근성 향상에 크게 기여할 것으로 기대되고 있다.

